二氧六环厂家为大家介绍二氧六环作为溶剂在高分散铜/镁铝复合氧化物催化剂的制备过程及性质!
在制备出具有相似比表面积和碱性可调的 MgO-Al 2 O 3 复合氧化物的基础上, 我们需要实现金属铜在这些载体上的均匀分散。 水溶液等溶液浸渍法是目前最为常用的负载型催化剂制备方法之一。 然而当碱性氧化物作为载体时, 如 MgO 和 MgO-Al 2 O 3 复合氧化物等, 水溶液与氧化物接触后呈碱性, 这使得水溶液中的金属阳离子会迅速转化为氢氧化物沉淀而无法均匀吸附在载体表面, 导致最终得到的金属粒子聚集严重。
这种情况在以 Cu 2+ 为金属源时表现得非常明显 [12] 。 在这里,Cu/MgO-Al 2 O 3 催化剂选择通过乙酸铜的乙醇溶液来进行制备以取代常用的水溶液, 实现金属 Cu 在碱性载体表面的高度分散。 如图 1 所示, 在金属 Cu 负载量为 2~6 wt%的范围内, Cu/MgO-Al 2 O 3 (3/1)催化剂的 X 射线衍射图只呈现出立方相MgO特征衍射峰(2θ=36。9°, 42。9°,62。3°), 而没有金属 Cu 对应的衍射峰。 这暗示金属 Cu在 MgO-Al 2 O 3 (3/1)载体上呈高度分散状态。 与之相反,在 使 用 乙 酸 铜 的 水 溶 液 来 进 行 浸 渍 时 , 4 wt%Cu/MgO-Al 2 O 3 (3/1)催化剂上可以明显观测到金属 Cu(200)晶面的特征衍射峰(2θ=50。4°)。 根据N 2 O化学吸附实验的结果, 在金属 Cu 负载量为 2~6 wt%的范围内,Cu/MgO-Al 2 O 3 (3/1)催化剂的 Cu 分散度约为 0。83(表 2),即在金属Cu高度分散的情况下, 催化剂表面Cu粒子的分散程度基本不受金属 Cu 负载量的影响。 而对于使用水溶液浸渍法得到的 4 wt% Cu/MgO-Al 2 O 3 (3/1)催化剂,其金属 Cu 的分散度却只有 0。14。
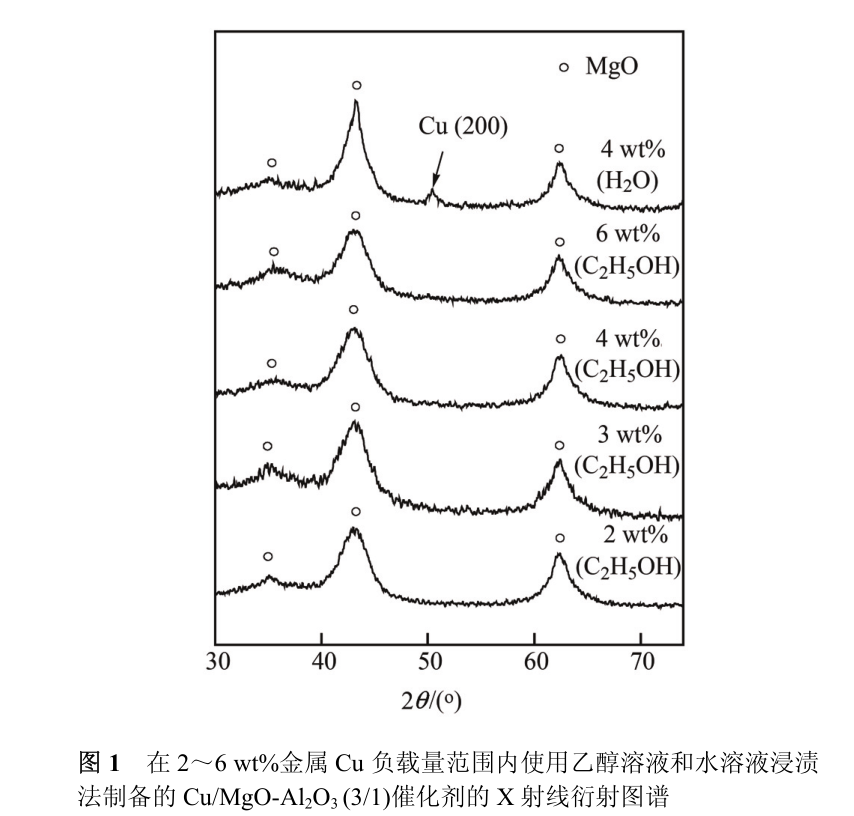
以上实验结果表明使用乙醇溶液浸渍法有效地实现了金属 Cu 在 MgO-Al 2 O 3载体上的高分散。 此外还注意到, 水与 MgO-Al 2 O 3 复合氧化物的相互作用会带来 MgO-Al 2 O 3 复合氧化物的重构, 使得在水溶液中浸渍后催化剂的表面积相比于新鲜载体显著下降, 而乙醇与MgO-Al 2 O 3 复合氧化物的相互作用要小得多, 使得乙醇溶液浸渍法可以让载体更好地保持原有的复合氧化物结构。
除了金属 Cu 的分散程度, Cu 粒子表面的脱氢能力是影响催化剂甘油氢解活性的另一个主要因素。 后者不仅取决于Cu粒子本身的结构, 还受到Cu与载体之间相互作用的影响。 N 2 O 化学吸附-H 2 程序升温还原是一种表征 Cu 粒子表面脱氢能力的有效手段。 在合适的温度范围内, N 2 O 会在 Cu 表面解离吸附而形成计量的吸附态氧原子 [22] 。 进一步通过 H 2 程序升温还原过程对吸附态氧原子进行滴定时, 氧原子的还原温度体现了 Cu 粒子表面对 H 2 的解离活化能力。
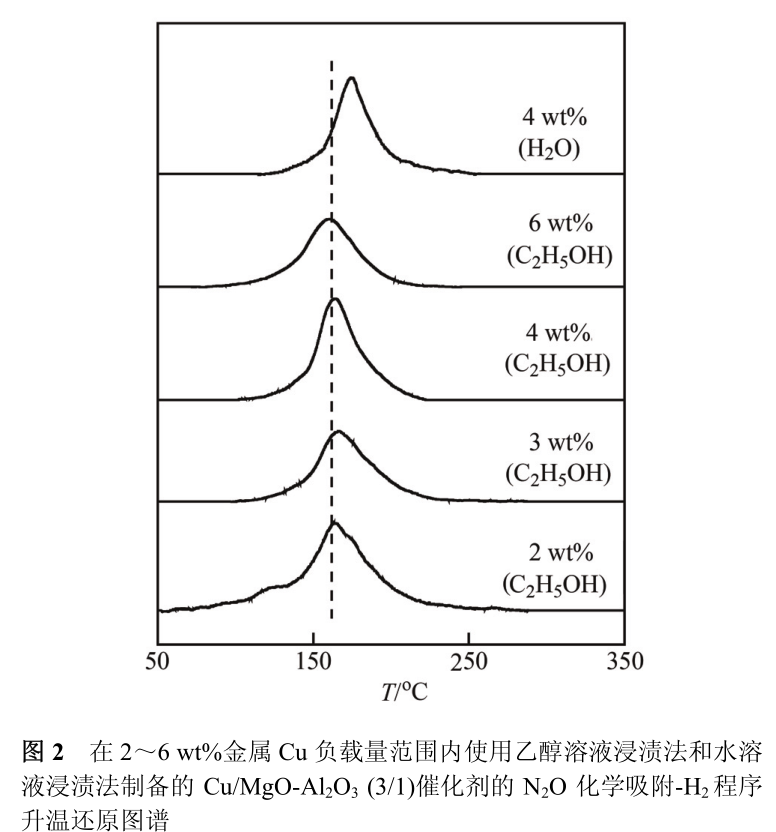
根据专业化工厂的研究结果, Cu 粒子对 H 2 的解离活化能力与其脱氢能力相关 [8] 。 吸附态氧原子的还原温度越低, Cu 粒子表面的 H 2解离能力越强, 对应的脱氢能力也越强。 图 2 展示了在Cu负载量分别为2, 3, 4和6 wt%时, Cu/MgO-Al 2 O 3 (3/1)催化剂表面吸附氧原子的H 2 程序升温还原图谱。 以上4个样品上的表面吸附氧原子均在 164 ℃附近呈现单一的还原峰。
这暗示 Cu 粒子在 MgO-Al 2 O 3 复合氧化物表面分散均匀, 且具有相似的H 2 解离能力和脱氢能力。 对比之下, 使用水溶液浸渍法得到的 4 wt% Cu/MgO-Al 2 O 3 (3/1)样品具有较低的金属Cu分散度, 其对应的表面吸附氧原子还原峰也出现在更高的 175 ℃处。 以上结果与我们在研究 Cu-ZnO 二元催化剂的甘油氢解反应催化性能时得到的结论一致, 即粒径小的 Cu 粒子具有更高的 H 2 解离能力和脱氢能力 。
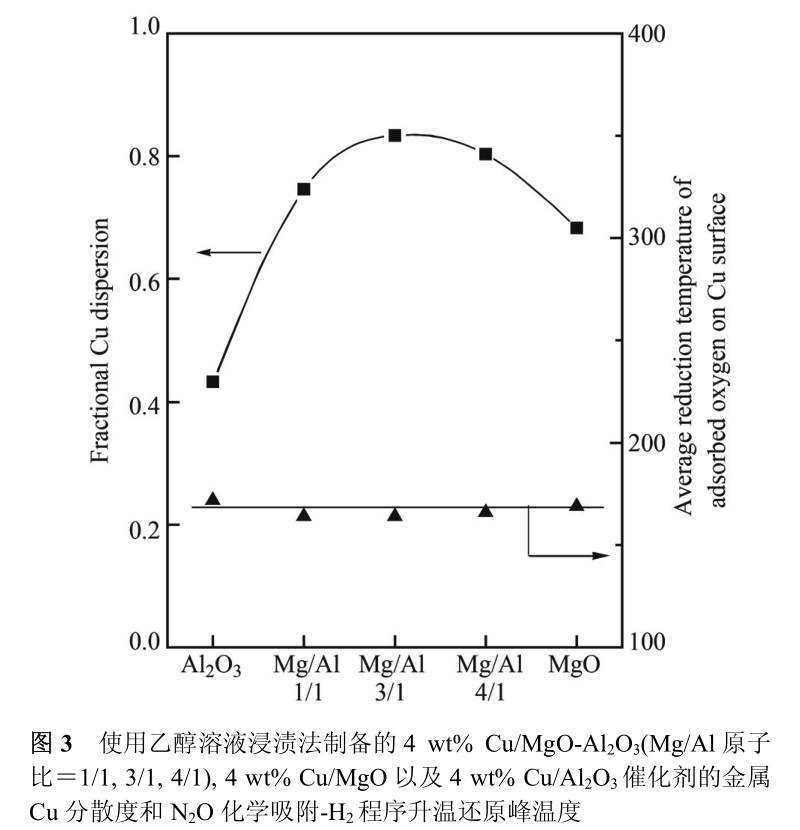
乙醇溶液浸渍法不仅可以在 MgO-Al 2 O 3 (3/1)复合氧化物上实现金属 Cu 的高度分散, 该方法还可以扩展至 Al 2 O 3 , MgO-Al 2 O 3 (1/1), MgO-Al 2 O 3 (4/1)和 MgO 等其它载体。如图 3 所示, 在保持 Cu 的负载量为 4 wt%的前提下, Cu 在 MgO-Al 2 O 3 (1/1)和 MgO-Al 2 O 3 (4/1)复合氧化物上具有与 MgO-Al 2 O 3 (3/1)上相似的分散度, 分别为0。75和0。80, 即MgO-Al 2 O 3 复合氧化物中的Mg/Al比例没有显著影响金属 Cu 的高分散状态。 在纯的 MgO载体上, Cu 粒子的分散度略降至 0。68, 这可能归因于MgO相对较低的比表面积(163 m 2 /g)。 而对于纯的Al 2 O 3载体, 尽管 Al 2 O 3 与 MgO-Al 2 O 3 复合氧化物具有相似的表面积(309~384 m 2 /g), 但Cu粒子在Al 2 O 3 载体上的分散度仅为0。43, 甚至低于 Cu 粒子在 MgO 载体上的分散结果。
这一现象暗示在使用乙醇溶液进行浸渍时, Cu 2+在 MgO 表面 Lewis 碱性位上的强吸附对最终形成的 Cu粒子的分散程度和稳定性可能起到了关键的作用。 在另一方面, N 2 O 化学吸附-H 2 程序升温还原实验的结果表明在以上5个铜基催化剂上的吸附态氧原子具有相近的H 2 还原温度(164~172 ℃, 图3), 因此以上催化剂中Cu粒子的本征脱氢能力相近, 即载体与 Cu 之间没有强相互作用, 载体组成的改变不会显著影响 Cu 粒子的 d 电子态。
综合以上结果, 我们通过乙醇溶液浸渍法合成出了高分散的 Cu/MgO-Al 2 O 3 复合氧化物催化剂, 并且催化剂中 Cu 粒子的本征脱氢能力不受金属 Cu 负载量和载体组成的影响。 进一步考察以上各催化剂的甘油氢解性能将有助于更准确地认识甘油氢解反应中碱性中心与金属中心之间的协同作用。