H NMR 确认了其结构, 同时测定了该类化合物的热稳定性、电导率以及对聚丙烯腈的溶解能力。 试验结果表明,大多数化合物的熔点较低, 为室温离子液体。 该类化合物具有较好的热稳定性, 可应用于电极和表面活性剂领域。 且N-甲基-N-丁基吗啉盐酸盐具备对聚丙烯腈的溶解能力。
室温离子液体(RTILs)主要指由有机阳离子和无机或有机阴离子构成的在室温或近于室温下呈液态的盐类, 具有很多分子溶剂不可比拟的独特性能。 室温离子液体蒸汽压低、液态温度和电化学窗口范围宽、热稳定性高、易制备, 因而近年来它的合成及应用成为国内外研究的热点 [1~ 4] 。 目前的离子液体大多由烷基吡啶或双烷基咪唑季铵盐阳离子与氯铝酸根、氟硼酸根、六氟磷酸根以及其它的阴离子构成。
但由于此类离子液体成本较高, 很难实现工业生产和应用。 因此, 低成本的离子液体的设计与合成已成为研究的重点。 最近有文献报道低成本吗啉季铵盐阳离子的离子液体容易制备, 且具有较好的电化学稳定性,已被成功用于电极等电化学领域 [5~ 7] 。
目前合成的用于制备吗啉离子液体的前体吗啉季铵盐主要是甲基吗啉溴盐。 但是, 关于这些新型化合物的物理、化学性能的研究甚少。 并且有关氮二烷基吗啉盐酸盐离子液体的合成与性能研究未见报道。 此外,关于新型离子液体化合物的物理、化学性能的研究,可为离子液体的应用提供参考。
为了进一步拓宽该类季铵盐在离子液体、表面活性剂和电极领域的应用,我们采用价格比较低廉的 N-甲基吗啉和 N-乙基吗啉为原料合成了系列新型的氮二烷基吗啉盐酸盐, 并利用1 HNMR,13 C NMR, TG, DSC 和元素分析对其结构和物理性质进行了表征并研究其与常规有机溶剂的相溶性, 测试了其对聚丙烯腈的溶解能力。 试验结果表明, 该类化合物具有很好的热稳定性, 并且 N-甲基-N-丁基吗啉盐酸盐能很好地溶解聚丙烯腈。
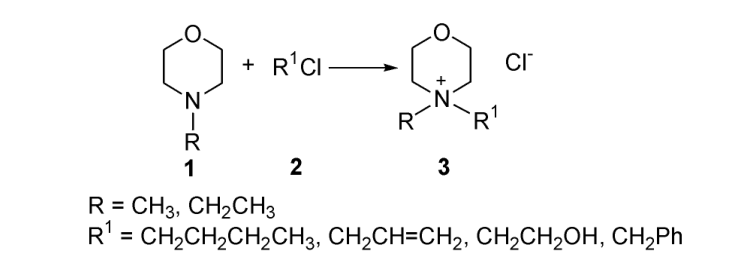
一、实验部分
1、仪器与试剂
自动分析仪;电导率仪;偏光显微镜;综合热分析仪(STA 409 PC), DSC(Perkin Elmer DSC7)丙酮、乙腈(分析纯)等溶剂经无水氯化钙干燥数天后, 加入金属钠回流蒸出。 其它试剂均为分析纯。1。2 合成
2、化合物
3a, 3b, 3e, 3g 的合成中间体 1 (0。1 mol)和中间体 2 (0。12 mol)加入到 100mL 的三颈烧瓶中, 加入 20 mL 乙腈做溶剂, 在磁力搅拌下加热, 控制反应温度, 反应完毕, 用旋转蒸发仪蒸除溶剂得到粗产品。 将粗产品用乙醚洗涤两次, 采用丙酮/乙醇混合溶剂重结晶, 得到目标化合物, 其理化数据见表 1。
3、化合物 3c, 3d, 3f 的合成
中间体 1 (0。1 mol)和中间体 2 (0。12 mol)加入到 100mL 的三颈烧瓶中,室温搅拌,反应完毕,过滤,将粗产品用乙醚洗涤两次,采用丙酮/乙醇混合溶剂重结晶,得到目标化合物, 其理化数据见表 1。
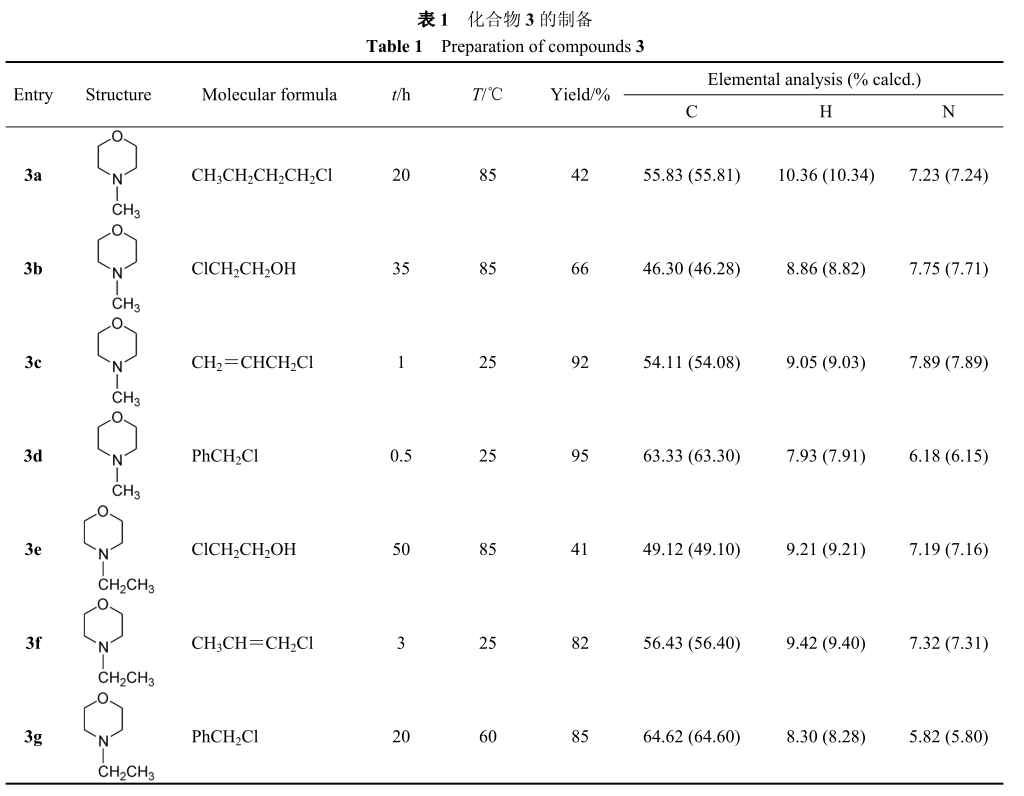
4、化合物 3a~3g 的结构表征
3a:白色固体, m。p。 90~91 ℃; 1 H NMR (300 MHz,CDCl 3 ) δ: 0。96 (t, J=7。2 Hz, 3H, CH 2 CH 3 ), 1。41~1。48(m, 2H, CH 2 ), 1。69~1。80 (m, 2H, CH 2 ), 3。48 (s, 3H, CH 3 ),
3。62~4。12 (m, 10H); 13 C NMR (75 MHz, CDCl 3 ) δ: 13。66(Bu-CH 3 ), 19。64 (CH 2 ), 23。69 (CH 2 ), 46。99 (NCH 3 ), 59。56(2C, NCH 2 ), 60。75 (Bu-CH 2 N), 65。09 (2C, OCH 2 )。
3b:白色固体, m。p。 45。3~46。5 ℃;1 H NMR (300MHz, D 2 O) δ: 3。27 (s, 3H, CH 3 ), 3。49~3。53 (m, 2H, CH 2 ),3。59~3。65 (m, 4H, CH 2 NCH 2 ), 4。02 (s, 6H, CH 2 OCH 2 ,CH 2 OH);13 C NMR (75 MHz, DMSO) δ: 48。17 (NCH3 ),54。85 (2C, NCH 2 ), 60。20 (CH 2 ), 60。31 (CH 2 OH), 65。09(2C, OCH 2 )。
3c:白色固体, m。p。 101~102 ℃;1 H NMR (300MHz, CDCl 3 ) δ: 3。53 (s, 3H, CH 3 ), 3。74 (s, 4H,CH 2 NCH 2 ), 4。06 (s, 4H, CH 2 OCH 2 ), 4。64 (d, J=6。9 Hz,2H, CH 2 ), 5。74~6。12 (m, 3H, CH=CH 2 )。
3d:白色固体, m。p。 151~152 ℃;1 H NMR (300MHz, D 2 O) δ: 3。08 (s, 3H, CH 3 ), 3。34~3。38 (m, 2H,CH 2 N), 3。56~3。59 (m, 2H, CH 2 N), 4。02~4。05 (m, 4H,CH 2 OCH 2 ), 4。58 (s, 2H, CH 2 Ph), 7。50~7。56 (m, 5H, Ph);13 C NMR (75 MHz, DMSO) δ: 45。39 (NCH3 ), 58。92 (2C,NCH 2 ), 60。31 (2C, OCH 2 ), 67。85 (CH 2 Ph), 127。76[C(4)-Ph], 129。34 [2C, C(3)-Ph], 130。78 [2C, C(2)-Ph],
133。71 [C(1)-Ph]。
3e:白色固体, m。p。 53~54 ℃; 1 H NMR (300 MHz,DMSO) δ: 1。23 (t, J=7。06 Hz, 3H, CH 2 CH 3 ), 3。39~3。46(m, 4H, CH 2 NCH 2 ), 3。48~3。70 (m, 6H, CH 2 CH 3 , NCH 2 -CH 2 OH), 3。92 (s, 4H, CH 2 OCH 2 ), 5。74 (s, 1H, OH);13 CNMR (DMSO, 75 MHz) δ: 7。45 (CH 3 ), 46。89 (CH 2 ), 55。31(2C, NCH 2 ), 58。23 (NCH 2 CH 2 OH), 60。15 (CH 2 OH), 62。03(2C, OCH 2 )。
3f:白色固体, m。p。 97~99 ℃; 1 H NMR (300 MHz,D 2 O) δ: 1。30 (t, J=6。86 Hz, 3H, CH 2 CH 3 ), 3。39~3。51 (m,6H, CH 2 , CH 2 NCH 2 ), 4。02~4。04 (m, 6H, CH 2 OCH 2 ,NCH 2 CH=), 5。65~5。71 (m, 2H, =CH 2 ), 5。87~5。98 (m,1H, CH=);
13 C NMR (75 MHz, CDCl3 ) δ: 7。60 (CH 3 ),54。54 (CH 2 ), 56。65 (2C, NCH 2 ), 60。33 (2C, OCH 2 ), 60。73(NCH 2 ), 123。52 (CH), 129。82 (=CH 2 )。
3g:白色固体, m。p。 161~162 ℃,1 H NMR (300MHz, D 2 O) δ: 1。43 (t, J=7。13 Hz, 3H, CH 2 CH 3 ), 3。39~
3。51 (m, 6H, CH 2 , CH 2 NCH 2 ), 4。03~4。06 (m, 4H, CH 2 O-CH 2 ), 4。59 (s, 2H, CH 2 -Ph), 7。50~7。55 (m, 5H, Ph); 13 CNMR (75 MHz, CDCl 3 ) δ: 8。10 (CH 3 ), 52。34 (CH 2 ), 55。23(2C, NCH 2 ), 60。35 (2C, OCH 2 ), 63。89 (CH 2 Ph), 126。58[C(4)-Ph], 129。17 [2C, C(3)-Ph], 130。65 [2C, C(2)-Ph],
133。48 [C(1)-Ph]。
二、结果与讨论
1、合成
在参考文献[8]中, 目标化合物 3c 的合成, 采用丙酮而在本文中室温搅拌反应 1 h, 就可得到 92%的产率。该方法具有不使用有机溶剂、反应时间短、产率高的特点。
此外反应时间对反应产率有很大的影响。 以化合物 3a 的合成为例, 反应时间 6 h, 产率很低, 几乎得不到产品, 延长反应时间至 10 h, 产率仅为 20%左右, 当反应时间延长到 20 h, 产率为 42%。 反应时间为 30 h,产率提高很少, 几乎不发生变化。 所以反应时间过长或过短都对反应不利。
2、DSC 分析
通过 DSC 测试, 得到化合物 3a~3g 的熔点分别为:90~91 ℃, 45。3~46。5 ℃, 101~102。0 ℃, 151~152 ℃,53~54 ℃, 97~99 ℃, 161~162 ℃。 除 3d, 3g 熔点在100 ℃以上不属离子液体外, 其余均属离子液体范畴,熔点在 100 ℃左右或低于 100 ℃。
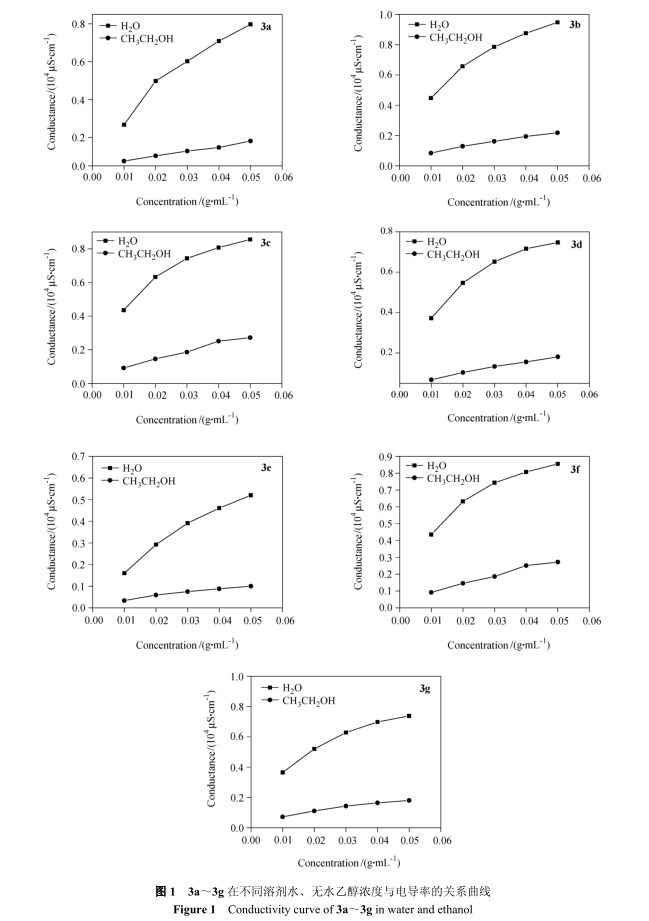
3、溶剂对离子液体电导率的影响
图 1 给出了 3a~3g 离子液体在不同溶剂水、无水乙醇中, 浓度与电导率关系曲线。 从图中可得出离子液体在不同的溶剂中的电导率不同, 而且相差很大。 从图中可得出离子液体在水中的电导率随离子液体溶液浓度的增大而明显增大; 在无水乙醇中电导率随浓度增大而增大的趋势小于以水为溶剂的变化趋势。 这是由于它们在不同溶剂中的溶剂化作用不同。 溶剂的结构与极性不同, 不同溶剂中由于溶剂分子对阴、阳离子的溶剂化作用不同, 溶剂对离子液体的溶剂化作用也有较大区别。 在不同溶剂中电导率其大小顺序为: 水>无水乙醇。
4、热重分析
由图 2 可见,化合物 3a~3g的热失重温度分别为219。3 ℃, 176。9 ℃, 143。1 ℃, 244。7 ℃, 226。4 ℃, 232。6℃, 182。7 ℃。 说明除了 3b 与 3c 以外, 其余 6 种吗啡啉季铵盐类离子液体均具有较高的热稳定性。
5、溶解性分析
溶解实验结果见表 2。
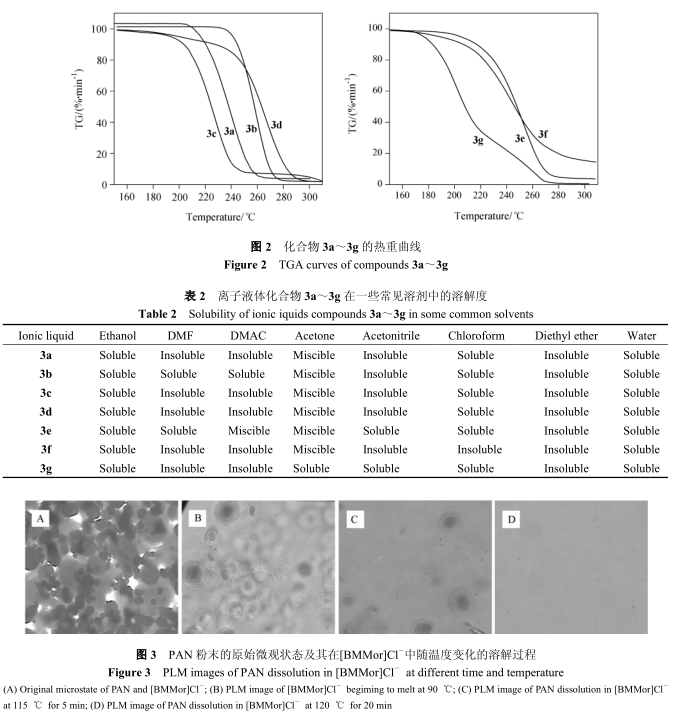
6、聚丙烯腈在离子液体中溶解形貌观察
离子液体不同于传统的溶剂, 其组成中没有分子,均为离子, 在离子液体中, 除了常规溶剂中存在的氢键、偶极力和范德华力外, 还有离子键。 其特殊的化学结构必然影响其与溶质聚丙烯腈大分子之间的相互作用, 甚至影响聚丙烯腈大分子的形态结构以及聚丙烯腈大分子之间的相互作用, 以下为聚丙烯腈在合成产物3a 中的溶解过程。聚丙烯腈溶解于离子液体后形成均匀透光、各向同性的溶液, 而未溶于离子液体的聚丙烯腈则会在正交偏光下显现出亮度较高的微观形貌。
图3是PAN粉末的原始微观状态及其在离子液体[BMMor]Cl- 中随温度变化的溶胀与溶解过程。
图 3A 是离子液体和 PAN 粉末在显微镜下的原始微观状态, 图3B是离子液体在90 ℃完全融化时 PAN 在[BMMor]Cl- 浑浊液的初始微观状态。 与图 3A 相比, 在图 3B 中可以看到 PAN 粉末颗粒分散在[BMMor]Cl- 中, 呈不规则球状, 颗粒中心颜色偏暗的是还没有被离子液体[BMMor]Cl- 浸润的部分, 相反,边缘部分则已被离子液体浸润。 当温度升至 115 ℃并停留 5 min 时, 可以看到颗粒中心颜色偏暗的部分己经大大减少(见图3C)。 当在120 ℃停留20 min时, 所有的颗粒消失, PAN 粉末已完全溶解于离子液体[BMMor]Cl-中(见图 3D)。